Từ 01/01/2017 đến 31/12/2017 cả nước ghi nhận 6.058 trường hợp phản ứng thông thường sau tiêm chủng và 31 trường hợp tai biến nặng sau tiêm chủng.
Từ 01/01/2017 đến 31/12/2017 cả nước ghi nhận 6.058 trường hợp phản ứng thông thường sau tiêm chủng và 31 trường hợp tai biến nặng sau tiêm chủng.
Phản ứng thông thường sau tiêm chủng: ghi nhận các trường hợp phản ứng tại chỗ (sưng, nóng, đỏ đau tại vị trí tiêm), sốt <39oC cả trong tiêm chủng mở rộng và tiêm chủng dịch vụ.
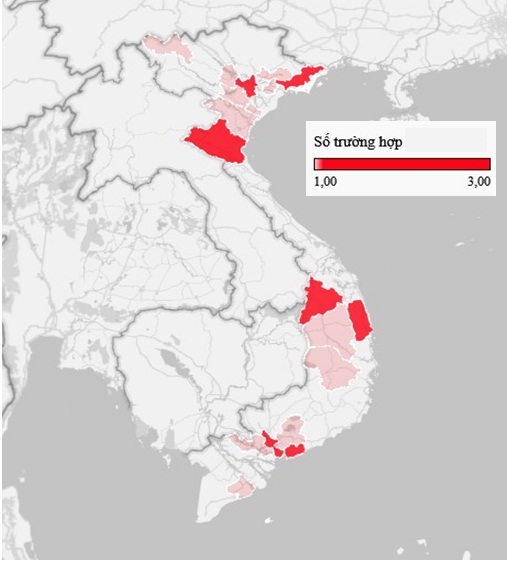
Tai biến nặng sau tiêm chủng: Ghi nhận 27 trường hợp tai biến nặng sau tiêm chủng các vắc xin trong TCMR tại 19 tỉnh, tỉnh, thành phố bao gồm (tử vong: 19, hồi phục: 8) trong đó: Lai Châu (01), Bắc Giang (01), Hòa Bình (01), Hà Nội (02), Hải Dương (01), Thanh Hóa (01), Nghệ An (03), Ninh Bình (01), Phú Thọ (01), Quảng Ninh (02), Bình Định (02), Đắk Lắk (01), Gia Lai (01), Kom Tum (02), TP. Hồ Chí Minh (02), Đồng Nai (01), Sóc Trăng (01), Long An (01), Bà Rịa - Vũng Tàu (02); và 04 trường hợp tai biến nặng sau tiêm chủng vắc xin tiêm chủng dịch vụ tại TP. Hồ Chí Minh, cả 04 trường hợp đều hồi phục.
Tai biến nặng sau tiêm chủng theo tỉnh, thành phố
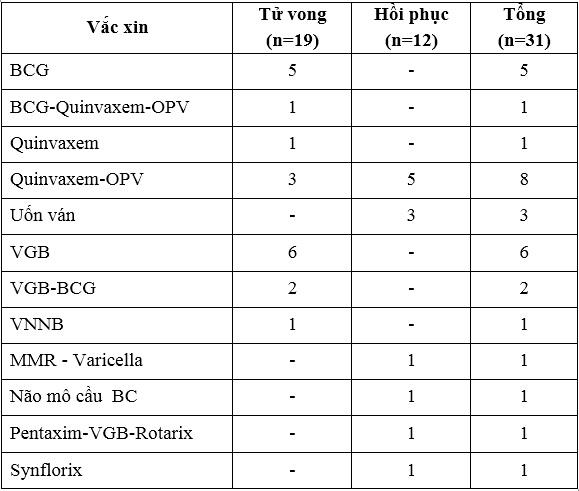
Về loại vắc xin sử dụng, trong 31 trường hợp tai biến nặng sau tiêm chủng ghi nhận:
- 05 trường hợp tử vong sau tiêm vắc xin BCG trên tổng số khoảng 1,6 triệu liều vắc xin BCG;
- 01 trường hợp tử vong sau tiêm vắc xin BCG - Quinvaxem-OPV,
- 01 trường hợp tai biến nặng sau tiêm vắc xin Quinvaxem, 08 trường hợp tai biến nặng sau tiêm vắc xin Quinvaxem-OPV (03 tử vong, 05 hồi phục) trên tổng số khoảng 4,8 triệu liều vắc xin Quinvaxem và 4,8 triệu liều vắc xin OPV đã sử dụng;
- 06 trường hợp tử vong sau tiêm vắc xin VGB và 02 trường hợp tử vong sau tiêm vắc xin VGB-BCG trên tổng số 1,3 triệu liều vắc xin VGB đã sử dụng;
- 01 trường hợp tử vong sau tiêm vắc xin Viêm não Nhật Bản trên tổng số khoảng 5,1 triệu liều vắc xin đã sử dụng;
- 03 trường hợp hồi phục sau tiêm vắc xin uốn ván trên tổng số khoảng 3,4 triệu liều vắc xin đã sử dụng;
- 01 trường hợp hồi phục sau tiêm vắc xin MMR và thủy đậu (Varicella) trên tổng số khoảng 18.100 liều vắc xin MMR và 30.700 liều vắc xin Varicella đã sử dụng;
- 01 trường hợp hồi phục sau tiêm vắc xin viêm màng não do não mô cầu (VA-Mengoc BC) trên tổng số khoảng 36.400 liều vắc xin đã sử dụng;
- 01 trường hợp hồi phục sau tiêm vắc xin Pentaxim-Engerix-Rotarix trên tổng số khoảng 173.300 liều vắc xin Pentaxim, 330.000 liều vắc xin Engerix và 75.700 liều vắc xin Rotarix đã sử dụng;
- 01 trường hợp tử vong sau tiêm vắc xin Synflorix trên tổng số khoảng 117.800 liều vắc xin đã sử dụng.
Tai biến nặng sau tiêm chủng theo loại vắc xin
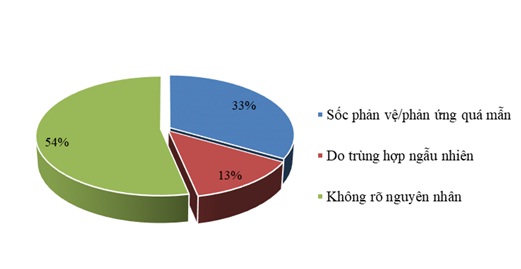
Trong tổng số 31 trường hợp tai biến nặng, 30 trường hợp đã được Hội đồng tư vấn chuyên môn đánh giá tai biến trong quá trình sử dụng vắc xin, sinh phẩm y tế cấp tỉnh và cấp Bộ (Hội đồng cấp tỉnh) đánh giá, kết luận, ghi nhận 04 trường hợp do trùng hợp ngẫu nhiên với bệnh lý của trẻ (13,3%); 16 trường hợp chưa rõ nguyên nhân, không liên quan đến tiêm chủng (53,4%); 10 trường hợp sốc phản vệ/phản ứng quá mẫn sau tiêm chủng (33,3%).
Tỉ lệ tai biến nặng sau tiêm chủng theo nguyên nhân
Tỷ lệ tai biến nặng sau tiêm chủng các loại vắc xin đều thấp hơn so với thống kê của Tổ chức Y tế thế giới.
- Kết quả giám sát công tác phản ứng sau tiêm chủng cho thấy 93,5 % trường hợp tai biến nặng sau tiêm chủng tiến hành tổ chức điều tra trong vòng 24h kể từ khi xảy ra trường hợp tai biến nặng (29/31 trường hợp); 02 trường hợp tai biến nặng sau tiêm chủng tại TP. Hồ Chí Minh tổ chức điều tra chậm so với thời gian quy định.
- 100% trường hợp tai biến nặng sau tiêm chủng đã được Hội đồng tư vấn chuyên môn đánh giá tai biến trong quá trình sử dụng vắc xin, sinh phẩm y tế cấp tỉnh họp và kết luận nguyên nhân. Trong đó có 16 trường hợp tổ chức họp hội đồng theo đúng thời gian quy định và 15 trường hợp tổ chức họp hội đồng chậm so với thời gian quy định: (Bà Rịa-Vũng Tàu 02 trường hợp, Bắc Giang 01 trường hợp, Bình Định 01 trường hợp, Hà Nội 02 trường hợp, TP. HCM 06 trường hợp, Hòa Bình 01 trường hợp, Ninh Bình 01 trường hợp, Thanh Hóa 01 trường hợp);
Các trường hợp tai biến nặng trong năm 2017 đều được tiêm chủng theo đúng quy trình. Tỷ lệ phản ứng thông thường và tai biến nặng sau tiêm chủng đều thấp hơn so với thống kê của Tổ chức Y tế thế giới.
Cục Y tế dự phòng, Bộ Y tế
Admin











 Tin tức nổi bật
Tin tức nổi bật
